Les dispositions du règlement européen sont applicables en France depuis le 31 janvier 2022.
Ce nouveau règlement européen a pour objectif :
- Le renforcement et l’accélération de la mise à disposition des innovations.
- Une harmonisation de l’évaluation et collégialité de l’approche.
- Une harmonisation des procédures et des délais et de certaines lignes directrices d’éthique.
- Une évaluation combinée avec une décision unique par état membre (partie I et II) et une conclusion identique entre états membres rapporteurs et concernés (EMR et EMC) pour la partie I.
- E-soumission : lien CTIS – SIRIPH2G (flux entrants), accès au CTIS par les CPP (RFI, FAR…).
- Une Intégration large des données européennes dans l’analyse pour l’autorisation d’un essai clinique.
- De faciliter l’accès à Information sur les essais ouverts.
- Le renforcement de la surveillance et de l’information disponibles sur les essais cliniques et les produits.
- Le renforcement la visibilité de l’évaluation.
- Le renforcement de la prédictibilité des calendriers d’autorisation des essais cliniques.
- De faciliter le dépôt des essais cliniques : une plateforme unique pour l’Europe.
Ces bénéfices ne remettent pas en cause la décision nationale puisqu’en effet l’évaluation scientifique européenne coordonnée est renforcée par l’avis de l’ANSM, qui aura recueilli l’avis des CPP mais la décision reste nationale en ce qui concerne l’évaluation éthique et le déroulement des essais cliniques en cours (4).
Il en découle néanmoins de ce nouveau règlement européen :
- Une adaptation du code de santé publique au niveau réglementaire et législatif puisque certaines des dispositions du règlement européen renvoient au droit national.
- Coordination : nationale (conseil d’état et autorités compétentes) et entre états membres.
En France, la préparation de la mise en place du règlement européen s’est faite aussi grâce au « projet CPP ambition 2020-2022 » qui avait pour objectif de la réduction des délais d’évaluation éthique des essais cliniques et une augmentation des moyens des CPP
D’autre part, le « plan santé innovation 2030 » a été annoncé récemment avec pour objectifs :
- Simplification et accélération de l’autorisation des essais cliniques
- Valorisation de l’expertise de l’évaluation éthique des CPP
- Alléger la charge du CPP en spécialisant certains CPP au traitement des dossiers médicaments Europe
- Simplifier et clarifier le rôle des CPP et de l’ANSM
- Création d’un guichet commun par l’ANSM
- Augmenter les moyens des CPP et RiPH
- Harmonisation des pratiques des CPP
Ce qui change en ce qui concerne la vigilance des essais cliniques, porte sur les notifications dans la nouvelle plateforme « clinical trials information system » (CTIS).

Le nouveau règlement européen prévoit désormais une analyse en deux parties du dossier d’essai clinique déposé
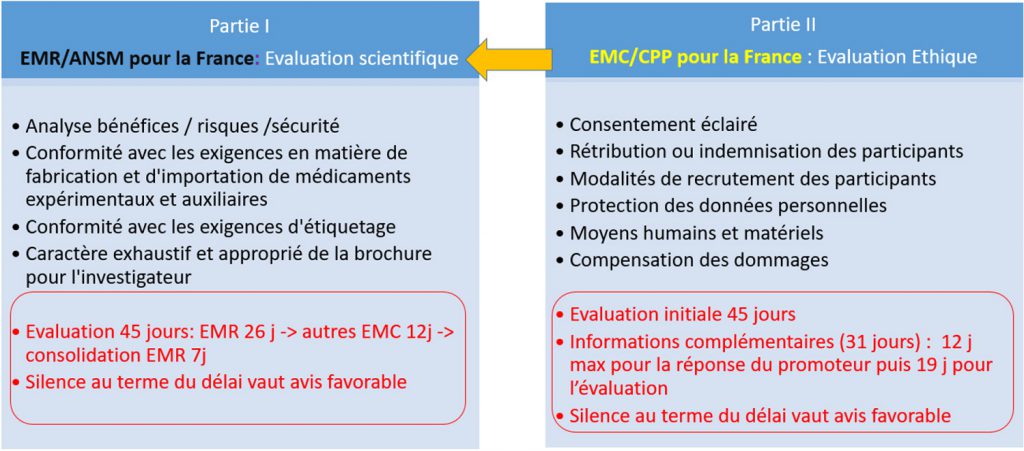
Délais des différentes étapes d’évaluation du dossier d’essai clinique déposé par l’industriel
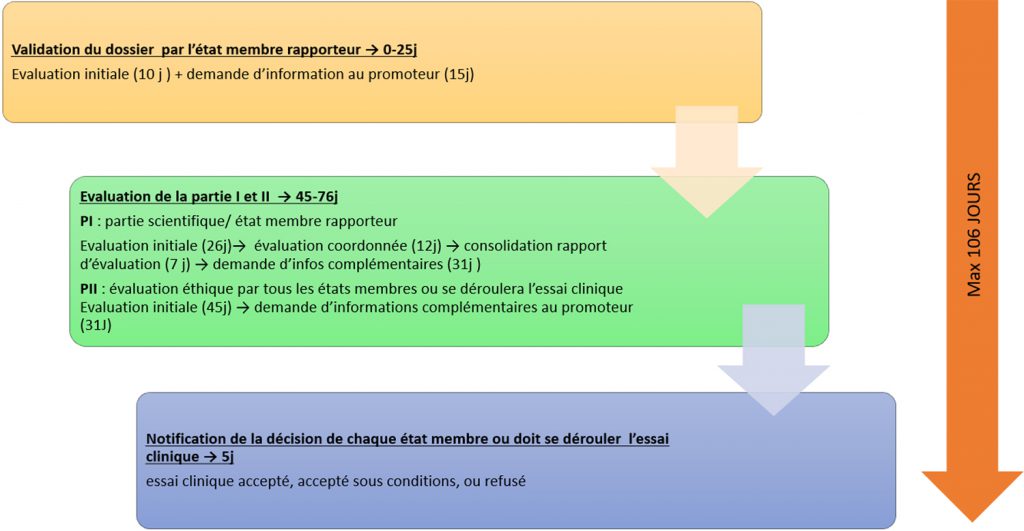
Avantages et inconvénients du nouveau règlement européen

4. HAS, ANSM. Règlement Essais Cliniques dédié aux promoteurs [Internet]. 2022. Disponible sur: https://ansm.sante.fr/uploads/2022/04/08/20220408-webinaire-rec-06-04-2022.pdf