Les recommandations de la Fleischner Society pour le suivi des nodules solides incidents ont été actualisées en 2017 (24,25). Ces nouvelles recommandations sont plus complexes. Elles introduisent la mesure volumique des nodules dont l’intérêt avait été démontré dans le cadre de l’essai de dépistage NELSON, mais avec des valeurs seuils plus conservatives (16,26). Elles introduisent également une différence entre l’existence d’un nodule unique et de nodules multiples. Enfin, la notion de risque individuel s’est complexifiée. On notera que ces recommandations ne sont PAS valables pour les moins de 35 ans, les immunodéprimés et les patients atteints de cancer. On peut proposer l’algorithme de synthèse ci-dessous.
Les scanners de suivi doivent être fait en mode volumique et coupes millimétriques (9).
Le suivi supérieur à 24 mois d’un nodule solide non évolutif n’est pas proposé par la Fleischner Society. Les essais de dépistage ont montré un bénéfice en termes de détection des cancers et de réduction de la mortalité pour des surveillances par imagerie allant jusqu’au-delà de 10 ans (27–29). Il ne s’agit toutefois par exactement de la même chose puisque ces imageries ont essentiellement pour but de détecter des nodules incidents solides connus pour être plus à risque (30).
La découverte d’un nodule incident doit faire reprendre l’algorithme à son commencement et nécessite une vigilance particulière.
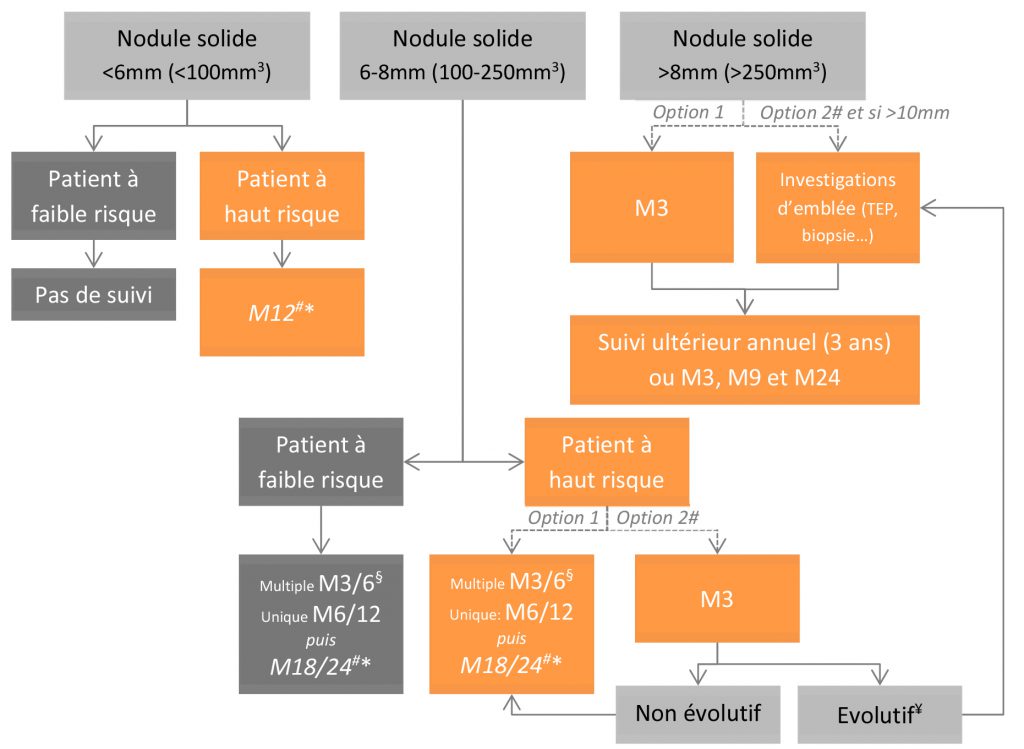
# Option à considérer en cas de risque élevé, notamment en lien avec les caractéristiques morphologiques (spiculation, lobes supérieurs…)
* Puis pas de suivi si pas d’évolution. En cas d’évolution, un suivi rapproché est nécessaire. Le temps de doublement volumique peut être calculé.
¥ Un temps de doublement court (<400 jours) est un argument pour déclencher des investigations complémentaires. Un temps de doublement >600j semble réduire de manière drastique tout risque de cancer.
§ En cas de nodules multiples (considérer le plus volumineux)
- Faible risque : Risque estimé de cancer bronchique <5% selon l’AACP : âge jeune, tabagisme minime ou non-fumeur, nodule de petite taille, contours réguliers, non situé dans un lobe supérieur (tous les critères doivent être présents).
- Haut Risque : Risque estimé de cancer bronchique > 5% : Tous les critères du faible risque non présents et/ou patient âgé, tabagisme important, ATCD de cancer, nodule de plus grande taille, contours irréguliers/spiculés, localisation dans un lobe supérieur.
9. Couraud S, Cortot AB, Greillier L, Gounant V, Mennecier B, Girard N, et al. From randomized trials to the clinic: is it time to implement individual lung-cancer screening in clinical practice? A multidisciplinary statement from French experts on behalf of the french intergroup (IFCT) and the groupe d’Oncologie de langue francaise (GOLF). Ann Oncol. mars 2013;24(3):586‑97.
16. Horeweg N, van Rosmalen J, Heuvelmans MA, van der Aalst CM, Vliegenthart R, Scholten ET, et al. Lung cancer probability in patients with CT-detected pulmonary nodules: a prespecified analysis of data from the NELSON trial of low-dose CT screening. Lancet Oncol. nov 2014;15(12):1332‑41.
24. MacMahon H, Austin JHM, Gamsu G, Herold CJ, Jett JR, Naidich DP, et al. Guidelines for Management of Small Pulmonary Nodules Detected on CT Scans: A Statement from the Fleischner Society. Radiology. 1 nov 2005;237(2):395‑400.
25. MacMahon H, Naidich DP, Goo JM, Lee KS, Leung ANC, Mayo JR, et al. Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology. juill 2017;284(1):228‑43.
26. van Klaveren RJ, Oudkerk M, Prokop M, Scholten ET, Nackaerts K, Vernhout R, et al. Management of lung nodules detected by volume CT scanning. N Engl J Med. 3 déc 2009;361(23):2221‑9.
27. Veronesi G, Maisonneuve P, Rampinelli C, Bertolotti R, Petrella F, Spaggiari L, et al. Computed tomography screening for lung cancer: Results of ten years of annual screening and validation of cosmos prediction model. Lung Cancer. déc 2013;82(3):426‑30.
28. Rota M, Pizzato M, La Vecchia C, Boffetta P. Efficacy of lung cancer screening appears to increase with prolonged intervention: results from the MILD trial and a meta-analysis. Annals of Oncology. 1 juill 2019;30(7):1040‑3.
29. Black WC, Chiles C, Church TR, Gareen IF, Gierada DS, Mahon I, et al. Lung Cancer Incidence and Mortality with Extended Follow-up in the National Lung Screening Trial National Lung Screening Trial Writing Team 1. J Thorac Oncol. 13 juin 2019;
30. Walter JE, Heuvelmans MA, de Jong PA, Vliegenthart R, van Ooijen PMA, Peters RB, et al. Occurrence and lung cancer probability of new solid nodules at incidence screening with low-dose CT: analysis of data from the randomised, controlled NELSON trial. Lancet Oncol. juill 2016;17(7):907‑16.