La prophylaxie des neutropénies repose sur les facteurs de croissance hématopoïétiques (FCH). Pour la prophylaxie de la neutropénie fébrile, on peut se poser la question d’y associer une antibioprophylaxie.
Les FCH sont utilisés dans les situations de prophylaxie ou de traitement des neutropénies fébriles (32,33). La prise en charge des neutropénies fébriles n’est pas abordée dans ce document. En oncologie thoracique, les FCH n’ont pas de place dans d’autres indications, notamment dans le traitement des neutropénies non fébriles (34). Les résultats thérapeutiques des FCH sont controversés. S’il est prouvé que leur utilisation diminue la fréquence, l’intensité et la durée des neutropénies et des neutropénies fébriles, ils n’ont pas apporté de preuve sur la réduction de la mortalité globale ou de la mortalité par infection, possiblement en raison de la relative rareté de ces complications graves en cancérologie pulmonaire.
En oncologie thoracique, les deux formes peuvent toutefois trouver leur place dans des situations différentes, en lien avec le type de protocole utilisé (avec ou sans J8, durée de l’intercure notamment). Il n’est en effet pas recommandé d’utiliser les FCH de manière concomitante à l’administration des produits de chimiothérapie. L’administration de FCH n’a jamais été validée lors de schémas de chimiothérapie hebdomadaires ou entre les J1 et J8 pour les protocoles en deux injections.
De ce fait, l’utilisation de GCSF en schéma hebdomadaire est faisable sur une cure courte tout comme les adaptations de posologie de cytotoxiques.
- Les douleurs au point d’injection et les réactions d’hypersensibilité,
- Les douleurs osseuses qui sont fréquentes (10-30%). Il convient de prévenir le patient et de suggérer la prise d’antalgiques standards de pallier 1. L’âge inférieur à 45 ans et des antécédents de douleurs osseuses sont des facteurs de risque de survenue de telles douleurs (36).
- Le risque de survenue d’une leucémie aiguë myéloïde ou d’un syndrome myélodysplasique exceptionnel (37), et de très rares cas de rupture de rate ont été signalés.
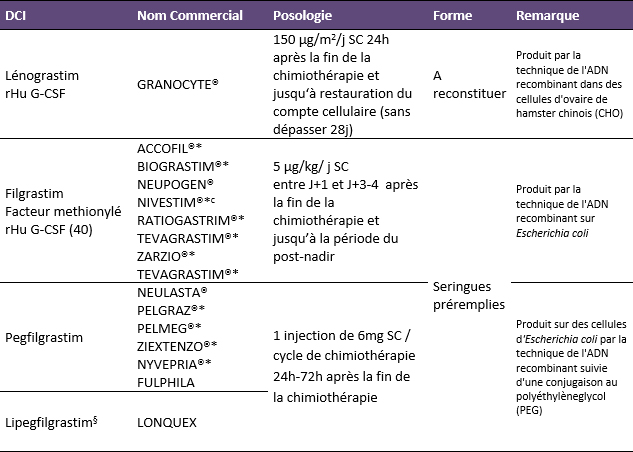
rHu : recombinant humain ‐ * indique un produit biosimilaire ‐ § Non commercialisé en France
32. Aapro MS, Bohlius J, Cameron DA, Dal Lago L, Donnelly JP, Kearney N, et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer. 2011 Jan;47(1):8–32.
33. Crawford J, Caserta C, Roila F, ESMO Guidelines Working Group. Hematopoietic growth factors: ESMO Clinical Practice Guidelines for the applications. Ann Oncol. 2010 May;21 Suppl 5: v248-251.
34. Smith TJ, Bohlke K, Lyman GH, Carson KR, Crawford J, Cross SJ, et al. Recommendations for the Use of WBC Growth Factors: American Society of Clinical Oncology Clinical Practice Guideline Update. Journal of Clinical Oncology. 2015 Oct 1;33(28):3199–212.
35. Phelip JM, Souquet PJ, Hacini M, Chehimi M, Bourgeois V, Bennoune R, et al. G-CSF filgrastim biosimilar-Sandoz reduces the incidence of febrile neutropenia in patients receiving chemotherapy regimens with rest periods not exceeding 14 days: A French, multicenter, prospective, non-interventional study. Cancer Treat Res Commun. 2023;35:100690.
36. Xu H, Gong Q, Vogl FD, Reiner M, Page JH. Risk factors for bone pain among patients with cancer receiving myelosuppressive chemotherapy and pegfilgrastim. Support Care Cancer. 2016 Feb;24(2):723–30.
37. Lyman GH, Dale DC, Wolff DA, Culakova E, Poniewierski MS, Kuderer NM, et al. Acute myeloid leukemia or myelodysplastic syndrome in randomized controlled clinical trials of cancer chemotherapy with granulocyte colony-stimulating factor: a systematic review. J Clin Oncol. 2010 Jun 10;28(17):2914–24.